-
 اوراق عمل تاسع الوحدة 1-ف1.rar (1.57 ميجابايت, 107 مشاهدات)
اوراق عمل تاسع الوحدة 1-ف1.rar (1.57 ميجابايت, 107 مشاهدات)
 اوراق عمل تاسع الوحدة 1-ف1.rar (1.57 ميجابايت, 107 مشاهدات)
اوراق عمل تاسع الوحدة 1-ف1.rar (1.57 ميجابايت, 107 مشاهدات)
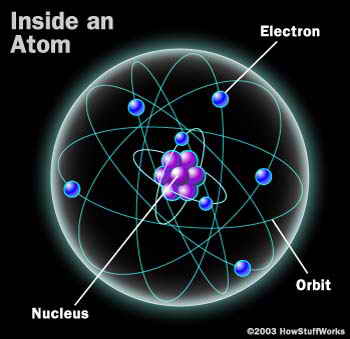
تتكون الذرة من نواة تحتوي على بروتونات ونيترونات , وإلكترونات تتحرك حول النواة.
الذرة : هي أصغر جزء من العنصر تدخل في التفاعل الكيميائي دون أن تنقسم.
الرابط مع علم الأحيـاء :
كما أنه هناك مجهر لدراسة الخلايا في الأحياء , فأنه هناك جهاز STM ( المجهر الأنبوبي ) لدراسة الذرات يوضح كيف تبدو الذرات. والفضل يعود إلى تقنية النانو.
1- الإلكترون The Electron
أكتشف الإلكترون عن طريق أنبوب أشعة المهبط ( الكاثود )
ملاحظة وليام كروكس :
على الرغم من أن الغازات عازلة للكهرباء ، إلا أنه إذا فرغ أنبوب زجاجي
من الغاز عند ضغط جوي منخفض، وفرق جهد كهربي عالي فإن الغاز يصبح موصلاُ للكهرباء,
وأن الأنبوب الزجاجي يشع أشعاعاً ( يضيء )

تابع العلماء أبحاثهم حتى أصبحوا مقتنعين بما يلي :
‘ أشعة المهبط عبارة عن سيل من الجسيمات سالبة الشحنة.
‘ تغير المعدن المكون للقطب أو تغير الغاز في الأنبوب لا يوثر في أشعة المهبط الناتجة.
‘ الجسيمات السالبة الشحنة لأشعة المهبط موجودة في جميع أشكال المادة.
‘ الجسيمات السالبة المكونة لجميع أشكال المادة هي الإلكترونات.
كما وجد أن الأشعة :
أ- لها القدرة على إدارة دولاب صغير موضوع في مسارها دلاله على أنها تمتلك طاقة حركية.
ب- لها القدرة على تسخين الأجسام التي تصطدم بها وهذا يعني أن لها طبيعة جسيميه أو مادية.
ج- عند وضع حاجز في مسارها يتكون للحاجز ظل دلالة على سيرها في خطوط مستقيمة.
د- إذا أثر عليها مجال كهربائي أو مغناطيسي فإنها تنحرف نحو المجال الموجب دلالة على كونها سالبة الشحنة.
2- البروتون والنيوترون :
لاحظ كتلة البروتون أكبر من كتلة الإلكترون بـ 1840مرة تقريباً.
‘ في عام 1920 استنتج راذرفورد أن النواة تحتوي على جسيمات تسمى البروتونات .
والبروتونات : يرمز لها بالرمز p+
وهي جسيمات موجب الشحنة تساوي شحنة الإلكترون توجد داخل النواة.
كتلة النيوترون مساوية لكتلة البروتون تقريباً.
‘ في عام 1920م منحت جائزة نوبل للعالم جيمس شادويك لإثباته أن:
النواة تحتوي أيضاً على جسيمات متعادلة كهربية سميت بالنيوترونات .
والنيوترونات : يرمز لها بالرمز ( n ):
هي جسيمات غير مشحون توجد داخل النواة.
إكمال نموذج الذرة :
الذرة : مكونة من نواة تحتوي P+ موجبة الشحنة و عديمة الشحنة e-P+
محاطة بمجال الكتروني يتحرك فيه e- سالب الشحنة
نفع الله به
التحميل الفلاش من هنا
تتكون العناصر من وحـدات صغيرة الحجم إلى مـد كبير تسمى الذرات ، إنالنقطةالتي تضعها على أي حرف أبجدي تحوي عدداً هائلاً من الذرات يصعبعلى أي إنسان تخيلـه ، ولم يستطع العلماء الذين يدرسون الذرات ويجـرونالأبحاث أن يحصلوا على ذرة واحدة مستقلة، إن هذا الأمر مستحيل حتى الآن ،ولكن تجمع الذرات مع بعضها بأعداد هائلة جداً شيء معروف ، فقطع المعادنالصلبة وكميات العناصر السائلة والغازية هي تجمعات هائلة من الذرات ، منهذا يتضح لنا أن حجم الذرة اللامتناهي في الصغر يجعل إمكانية تخيلها أمـراً فيغاية الصعوبة ، ومع ذلك فقد تمكن العلماء من اعتماد صورة مبسطة ومعبرةللذرة وذلك حسبما تجمع عندهم من معلومات ومعطيات .
معرفةنسبة الحديد في رقائق الذرة ‘ الكورن فليكس ‘
المشاركون :
إشراف الأستاذ الفاضل:
المقدمة :
يعد الحديد من المكونات الغذائية المهمة حيث يدخل في تركيب هيموجلبين الدم . وتمت إضافة الحديد إلى العديد من المنتجات الغذائية لتلبية احتياجات الجسم لهذاالمكون الغذائي . ومن أهم المنتجات التي تم تعزيزها بالحديد ((رقائق الذرة ومسحوقحبوب القمح )).
وبالإضافة إلى أهمية الحديد كمكون غذائي ، فإن ارتفاع نسبتهعن المطلوب يؤدي إلى تلف الكليتين.
وفي هذا المشروع سنقوم بفصل الحديد منالعينات الغذائية ثمقياسها ومقارنة النسبة المحسوبة بتلك المدونة على ملصق العلبة ،وتصدر حكماً على جودة المنتج الغذائي .
أهمية عنصر الحديد في الجسم :
فيما يلي إطلالة سريعة على عنصر الحديد تبين أنه عنصر بالغ الأهمية فيالجسم؛ إذ أنه:
1-
مهم في إنتاج الهيموجلوبين في كريات الدمالحمراء-2
مهم في إنتاج ميوجلوبين العضلات.3-
كما أنه ضروري في عملأنزيمات كثيرة بما فيها الكاتلاز وهو عبارة عن أنزيم موجود في عدد من الخلايا مثلكريات الدم الحمراء ليساعدها على التخلص من بعض المواد الضارة إذ يحول مادة الـ H2O2 إلى H2O+ O2.يظهر مما تقدم أهمية الحديد لجسم الانسان ، ولا بد منالتعرف على حاجه الجسم اليومية من الحديد ، لتعويض ما يفقده منه ؛ حيث يقدر مايفقده جسم الانسان يوميأ من الحديد:
حوالي 1 ملغم من خلال إخراج الفضلاتوالعرق. يضاف إلى ذلك:
الفئة والجنس العمر الكمية
المرضعات 9 ملغم / يوم
أهداف المشروع :
1)
معرفة نسبة الحديد في الموادالغذائيةالأدوات المطلوبة :
1-
كورن فليكس2-
كيسبلاستيك3-
مغناطيس4-
ميزان ( لقيلس كتلة الحديد )خــطــوات الــعــمــل :
1-
أحضر كيس بلاستك شفاف أي حجم …وضعفيه ماءضع خمس إلى ست ملاعق كورن فلكس كبير من الذي يوجد فيه صوره الديكالاخضر….في الكيس الذى فيه الماء
3- حاول إذابة (كورن فلكس) بالماء وهوبالكيس
4-
أغلق الكيس ثم إنفخ الكيس…..وأربطه بأحكام5-
رج الخليطالذي في الكيس لأذابة أكبر كمية من الكورن فلكس6-
أحضر مغناطيس…وألصقهبالكيس من الخارج وأسحبه من اسفل الكيس إلى الأعلى ….أكثر من مرةسوفتفاجىء بالتصاق كمية من برادة الحديد بالمغناطيس من داخل الكيس
تسجيلالبيانات :
g
كتلة الكورن فليكس =0.005100X
نسبة الخطأ = القيمة القبولة – القيمة المقيسةالنتائج :
التوصيات :
ننصح بأكل الكورن فليكسلإحتوائه على الحديد المطلوب في الجسم terto81Xlive.com
موفقين
تمرين (1) : أكمل الفراغ في العبارتين التاليتين :
العدد الموضوع اسفل رمز العنصر والى يساره هو عدده الذري وهو عدد ــــ الموجودة في نواة ذرته .
العدد الموضوع أعلى رمز العنصر والى يساره وهو العدد الكتلي وهو مجموع عدد ــــ و ــــــ في نواة ذرته .
تمرين (2) :
عدد التأكسد :
عدد التأكسد (حالة التأكسد) : الشحنة التي يبدو كأن الذرة تحملها مقداراً وإشارة .
مثال : عدد تأكسد المغنيسيوم في المركب الأيوني MgO ، هو (+2)
قواعد حساب عدد التأكسد :
القواعد الآتية يجب أن تؤخذ بالاعتبار عند تحديد عدد تأكسد العنصر في المركب :
1– عدد تأكسد العناصر النقية يساوي صفراً .
أمثلة :
عدد تأكسد الكلور Cl2 يساوي صفراً.
عدد تأكسد الفوسفور P4 يساوي صفراً.
عدد تأكسد الكبريت S8 يساوي صفراً.
2- عدد التأكسد للأيون البسيطيساوي العدد الذي يحمله في المقدار وفي الإشارة .
4-عدد تأكسد الهيدروجين هو (+1) .
أمثلة :
عدا حالة واحدة يكون عدد تأكسد الهيدروجين فيها ( -1 ) وذلك إذا اتحد مع عنصر أقل كهروسلبية فيه كما في هيدريدات الفلزات .
أمثلة :
5– عدد تأكسد الفلزات دائماً موجب.
لماذا ؟ لأن الفلزات دائما تميل لفقد الالكترونات.
6– عدد تأكسد فلزات عناصر المجموعة (IA) دائماً هو(+1) .
Na

المقدمة:
المادة هي كل ما له كتلة وكل ما يتكون منه الأجسام الفيزيائية، من غير حساب الطاقة لهذه الأجسام (بالرغم من أنها قد تغيير كتلة الجسم) , و قد تغير اعتقاد الانسان كثيرا عبر العصور حول هذا التركيب المادي من تقسيم الطبيعة الى أربعة عناصر اساسية الى اكتشاف العناصر الكيميائية الى اكتشاف الذرة فمكونات الذرة و الآن نتحدث عن الفرميونات الأولية . أما البوزونات بما فيها الفوتونات فلا يمكن اعتبارها مادة .
الموضوع:
يتكون الكون الطبيعى "الذى يشتمل على كائنات حيه" من مادة وطاقه وهما يعتبران اساس جميع الظواهر المحسوسة
تعريف المادة:
هى كل ما له حجم وكتلة ويشغل حيزا و تتحول المادة من حاله الى اخرى
ونلاحظ ان المادة عندما يحدث لها التغير يكون تغير كيميائى او تغير فيزيائى.
التغير الكيميائى:
هو التغير الذى يحدث فى تركيب المادة وينتج عنه مواد جديدة
والتغير الفيزيائى:
هو التغير الذى يحدث فى تركيب المادة ولاينتج عنه مواد جديدة اىيحدث فى مظهر المادة فقط وعند دراسة المادة وجدا انها اما ان تكون متجانسه او غير متجانس و تتكون المادة من وحدات بنائيه صغيرة وتسمى الجزيئات ومفردها الجزئ ويلاحظ ان الجزئ يتكون من وحدات بنائيه اصغر تسمى ذرات ويلاحظ ان جزيئات المادة الواحدة اذا كانت متجانسه تكون متشابه وجزيئات المادة اذا كانت غير متجانسه تكون غير متشابه.
(حالات المادة)
الحالة الصلبة:
تتميز المواد الصلبه بان لها شكل معين وحجم معين وتتحول المادة من الحاله الصلبه الى الحاله السائله وتسمى هذة العمليه بعملية الانصهار.
.
الحاله السائله:
وتتميز المواد السائله بانها تاخذ شكل الاناء ولها حجم معين وتتحول المادة من الحاله السائله الى الحاله الصلبه وتسمى هذة العمليه بعملية التجمد.
الحالة الغازية:
وتتميز المواد الغازيه بان ليس لها شكل معين ولا حجم معين وتتحول المادة من الحاله الغازيه الى الحاله السائله وتسمى هذة العمليه بعملية التكثيف اما عند تحول المادة من الحاله السائله الى الحاله الغازيه تسمى بعمليه التبخر.
(تحولات المادة)
الانصهار:
هو تحول المادة بالحرارة من الحاله الصلبه الى الحاله السائلة وتتميز المواد الصلبه بان قوة الترابط الجزيئية تكون كبيرة جدا والمسافات البينية تكون صغيرة جدا وتهتز الجزيئات في مكانها ولاتتحرك من مكانها لذلك تحتفظ المواد الصلبه بشكل ثابت وحجم ثابت وعند تسخين المادة الصلبة اى تزويد جزيئاتها بالحرارة فأنها تهتز بسرعة أكبر للتغلب على قوة التجاذب بين هذة الجزيئات بمساعدة الحرارة التي تكتسبها من التسخين وعند درجة حرارة معينه تسمى درجة الانصهار تتغلب الجزيئات على قوة التماسك بينها وتتحرك من مواضعها فتتحول المادة من الحالة الصلبة الى الحالة السائلة فيما يعرف بالانصهار..
التصعيد أو التبخر:
هو تحول المادة بالحرارة من الحالة السائلة إلى الحالة الغازية وتتحرك جزيئات السائل حركه مستمرة ولكنها لا تبتعد كثيرا من بعضها ونلاحظ ان قوة الترابط الجزيئية في هذه الحاله صغيرة جدا
(الجزئ)
هــو وحــدة بنــاء المـــادة وهو اصغــر جزء من المـــادة يمكـــن ان يوجــد منفـــــردا ويظل محتفظـــــا بخـواص المــــادة وصفاتهــــا ونلاحـــــظ ان جزيئـات المـــــادة فى حالة حركـــــه مستمـــرة هذة الحركه أكبـــــر ما يمكــــن تكــــون فى حـالة المـــواد الغازيــــه ويتبعهــــا السوائل أما جزيئــــات المواد الصلبـــــه فحركتهــا قليله جدا فهــــى تهتز فى مكانهــــــا فقط بدون ان تنتقل إلى مكـــــان اخـــــر توجــــد مسافـــات بينيـه اى فراغـات بين جزيئــــات المادة وتكون كألاتى:-
المــواد الصلبـــه: تكون فيهــا المسافــــات البينيـه للجزيئـــات صغيرة جــدا
المواد السائلـــه: تكــون فيها المسافــات البينية للجزيئات متوسطة الحجم
الغــازات: تكـــون فيهــــا المسافـــات البينيــه للجزيئـــــات كبيــرة جـــــــدا
والجــزئ: يتكـــون من وحـــدة بنائيـــه اصغــــر منــــــه وتسمــــى الذرة ونلاحظ أن جـــزئ الأكسجين :يتكـــون من ارتبــــاط ذرتـــى اكســــجين وجــــزئ الهيـــــدروجين يتكـــــون من ارتبــــاط ذرتــــى هيــــدروجــــين وجــــزئ المـــــاء يتكــــون من ارتبــــاط ذرتـــــى هيدروجــــين مع ذرة اكســــجين وجــــزئ ملـــح الطعــــــام ويسميـــــه العلمـــــــــاء كلــــوريد الصوديــــــوم يتكــــــون مـــن ارتبــــــاط ذرة صوديــــــوم مـــــــــع ذرة كلـــــــــور.
(الـذرة)
(وحدة بناء المادة)
بناؤها ـ وزنها ـ أبعادها
مع فكرة عن الجدول الدّوري التضيف العناصر
لمندلييف
الذرة هي أصغر جزء في الكون وقد سميت باللغة الأجنبية Atom
أي الجزء الذي لا يتجزأ
وقد كان يظن في القديم أنها اصغر شيء وهي جزء واحد لكل العناصر
ولكن العلم الحديث وجهود العلماء التي بذلت في القرن الحالي استطاعا أن يصلا إلى تحديد أساسي جوهري لبنية الذرة .
فلقد وجدوا ان الذرة بتركيبها هي أقرب ما تكون للنظام الشمسي ،
فهي تتكون من الناحية المبدئية من ثلاثة أجزاء :
في المركز يتوضع البروتون وهو ذو شحنة ايجابية
ومعه النترون وهو ذو شحنة حيادية
وهناك في المدارات الخارجية تتوضع الالكترونات وهي ذات شحنة سلبية ،
وعدد البروتونات الموجودة في النواة تساوي عدد الاكترونات المتوضعة في المدارات الخارجية ،
وهكذا تتوازن الذرة من الناحية الكهربائية ،
وأما وزن الذرة فهو يتوقف بشكل أساسي على البروتون والنترون ، حيث يوازي النترون من ناحية الوزن البروتون ويشكل معه الوزن الأساسي للذرة .
ولقد وجد أن وزن البروتون هو1,6×10 ـ24 غرام ، أي أن الغرام الواحد من الناحية الوزنية يساوي مليون مليار مليار مرة ، أو بكلمة أخرى أن وزن البروتون هو جزء من مليون مليار مليار من الغرام على وجه التقريب ، والنترون ذو الشحنة الحيادية يقترب بالوزن من وزن البروتون ، ولذا يشكل مع البروتون كما ذكرنا وزن الذرة .
أما الاكترون فهو أخف من البروتون بكثير وان كان يعادله من ناحية الشحنة الكهربائية ، فوزن البروتون يساوي 1837 مرة وزن الالكترون ؛ ولذا فان الأخير ذو وزن صغير جداً إذا قيس بالبروتون ، وأما الشحنة الكهربائية للالكترون أو البروتون المتعادلين فهي تساوي 1,6 × 10 ـ19كولون ( وحدة من وحدات الشحنات الكهربية ) ، وأما من ناحية الأبعاد فالذرة تشبه شكلاً كروياً ، وقطرها ضئيل يعادل الانغستروم ( 10 ـ8 سم ) أي جزء من مائة مليون من السنتمتر ، ولكن العجيب يكمن في ان قطر النواة هو من رتبة 10 ـ12سم أي أصغر من قطر الذرة بـ 10 آلاف مرة ، بحيث لو اننا كبرنا على سبيل المثال ذرة الهيدرجين مليار مرة فان الذرة تصبح كرة يبلغ قطرها قدمين ، ولكن الكتلة الذرية أي النواة ستجتمع ( بروتونات ونترونات ) بشكل حبة الرمل في مركز الكرة والسبب في هذا يعود إلى الفراغ الهائل في تكوين الذرة ما بين البروتونات والالكترونات ، وهو كما ذكرنا ينوف على 10 آلاف مرة وهو في الحقيقة أمر يدعو إلى الدهشة والحيرة في أسرار الذرة وألغازها التي كشف القرن الحالي عنها .
ونضرب مثلاً على ذلك فنقول : لو أن عشرة ملايين ذرة اجتمع بعضها بجانب بعض ، فإنها تبلغ طولاً قدره مليمتر واحد فقط ،
والغريب هو فيما يسمى بعدد افوغادرو أو الذرة الغرامية فما هي يا ترى أعداد الذرات في غرام واحد من الهيدروجين مثلاً ؟ . يقول العلماء انهم توصلوا إلى حساب عدد الذرات الموجودة في غرام واحد من الهيدرجين بطرق متعددة ومعقدة ، وكلهم اتفقوا على رقم واحد هو 6,2 × 10 23أي إذا أردنا أن نسميه فنقول إن غراماً واحداً من الهيدرجين فيه 600 ألف مليار مليار ذرة ، وهو عدد يجعل الرأس يدور ويعجز عن التخيل والتصديق وخاصة إذا ضربنا هذا المثل : وهو لو اننا وضعنا هذه الذرات جانب بعضها بعضاً في خط مستقيم فكم سيكون طول الخط الذي ستشكله هذه الذرات من غرام واحد فقط من الهيدرجين ؟ إن هذا الخط سيكون بطول 400 ضعف عن الطول الممتد ما بين الشمس والارض والذي هو 93 مليون ميل لأن الخط هو 60 مليار من الكيلومترات وهو رقم محير فعلاً ..
أقسام الذرة ومكوناتها :
تتكون الذرة (كما يظهر في الشكل) من قسمين أساسيين :
النـواة : وهي صغيرة الحجم موجبة الشحنة وثقيلة الوزن بالنسبة لباقي مكونات الذرة .
المحيط الخارجي : وهو عبارة عن مجموعـة مستويات تتحـرك فيها الإلكترونات حول النواة بسرعة هائلة ، والمحيط الخارجي كبير الحجم مقارنة بالنواة وسالب الشحنة وخفيف الوزن, أي أن صفاته تعاكس صفات النواة. ويجب أن يذكر من الآن أننا عند الرسم على الورق لا نستطيع أن نراعي نسبة حجم النواة إلى حجم المحيط وهي
1 : 100000
ما الدقائق التي تتكون منها الذرة في النواة وفي مستويات المحيط الخارجي ؟
هذا ما ستعرفه الآن ، تحوي النواة نوعين من الدقائق هي :
البروتونات (Protons) :
المقطع (Proto) يعني الأصل أو الأساس ، وهذا هو المكون الأولي للذرة والمسؤول عن خواصها ،والبروتونات دقائق تحمل شحنة موجبة (+) وثقيلة الوزن .
النيوترونات (Neutrons ) :
هذه الدقيقة متعادلة ولا تحمل شحنة وهذا هو معنى كلمة نيوترون . النيوترونات هي اثقل دقائق الذرة
وزنـاً فـوزن النيوترون اكبر بمقدار ضئيل من وزن البروتون .
أما مستويـات المحيط الخارجي فتتحرك فيها دقائق من نـوع ثالث هي الإلكترونات (Electrons) ومقطع (Electro ) معناه
( كهربائي)، والإلكترون دقيقة تحمل شحنة سالبة (-) معادلة بالضبط لشحنة البروتون الموجبة ، أما وزنه فهو خفيف جدا ويعادل1/1836 من وزن البروتون.
تركيب الذرات :
لا تختلف إلكترونات ذرة عنصر عن إلكترونات ذرة عنصر آخر من حيث تركيبها ، ولكنها تختلف عن بعضها في سلوكها ، ففي بعض الذرات نجد الإلكترونات حرة الحركة وسهلة الانتقال إلى ذرة أخرى , وفي ذرات أخرى نجدها مستقرة وغير ميالة للتحرك والانتقال .
تتحرك الإلكترونات أحياناً في دائرة مغلقة فتبقى تدور وتدور دون توقف وهذا هو حال إلكترونات التيار الكهربائي ، فطالما وجدت المضخة ( المولد الكهربائي ) التي تدفعها وتحركها فإنها تستمر في التحرك مولدة التيار الذي يشغل الأجهزة الكهربائية المختلفة .
بعض إلكترونات الذرات تبقى دائماً في حضن والديها ( البروتونات والنيوترونات ) وهذه هي الكترونات المستويات الداخلية لذرات العناصر المختلفة ، ومثلها إلكترونات ذرات الغازات النبيلة ، إن عملية تحريك الإلكترونات التي ذكرناها يتطلب طاقة زائدة وشروطاً خاصة ، يمكن أن تشبه هذه الإلكترونات بالأطفال المدللين فأبواهم يحبونهم وهم سعيدون بكنف أبويهم ولا يريدون مغادرة هذا المكان الذي يجدون فيه الراحة والطمأنينة .
تركيب الذرات :
والخلاصة إن إلكترونات الحديد تشبه إلكترونات الكلور في تركيبها ولكنها لا تشبهها في سلوكها ، فالكترونات الحديد تتحرك وتنتقل وتوصل تياراً كهربائياً ، بينما إلكترونات الكلور تبقى في كنف والديها وعندما تكون الفرصة مواتية تضم كل ذرة كلور إلكتروناً آخر وتتحول إلى أيون سالب . أو أنها تقوم بعمل روابط كيميائية مشتركة مع ذرات عناصر آخرى تتكون الرابطة الواحدة منها من إلكترونين يأتي كل واحد منهما من ذرة .
الخلاصة :
هنالك عناصر تتخلى عن بعض إلكتروناتها بسهولة ، وهذه هي الفلزات الموصلة للحرارة والكهرباء والصلبة على وجه العموم ( مع قلة منها في الحالة السائلة ) ، ولا يوجد منها أي واحد في الحالة الغازية ( تحت درجة حرارة المختبر وضغط جوي نظامي) .
وهنالك عناصر تتمسك بإلكتروناتها وتحتضنها ولكنها تسمح لها بعمل روابط مشتركة مع عناصر أخرى لها ذات السلوك ، وتسمى هذه العناصر باسم اللافلزات ، معظم اللافلزات غازات ولكن يوجد منها واحد سائل وعدد قليل صلب ولكن درجات انصهارها وغليانها منخفضة بالمقارنة مع درجات انصهار وغليان الفلزات المرتفعة عموماً .
إن شاالله اكون أفدتكم ولو بشيء بسيط
منقـــــــول
 بنية الذرة 6.zip (631.0 كيلوبايت, 3085 مشاهدات)
بنية الذرة 6.zip (631.0 كيلوبايت, 3085 مشاهدات)
 لو سمحتوا ممكن حل درس الذرة كتاب التلميذ
لو سمحتوا ممكن حل درس الذرة كتاب التلميذ 
صفحة 27
9:
أ. بعد تجربة رذرفورد
ب. قبل تجربة رذرفورد
10.
أ بروتون
البروتون احد مكونات النواة و هو جسيم ذو شحنة موجبة و كتلة كبيرة نسبيا.
ب نيترون
النيترون احد مكونات النواة و هو جسيم متعادل الشحنة له كتلة كبيرة نسبيا
ج. الكترون
الالكترون جسيم سالب الشحنة له كتلة صغيرة جدا و يتواجد في السحابة المحيطة في النواةتعداد الذرة: